INTRODUCIÓN:
El Nódulo Pulmonar Solitario (NPS) es un hallazgo incidental frecuente en los estudios torácicos realizados durante la práctica clínica diaria. Cada vez es mayor el uso de técnicas diagnósticas como la radiología simple de tórax, así como el uso de técnicas más sensibles como la TC, lo que supone un aumento de la probabilidad de encontrar como hallazgo casual un nódulo pulmonar.
El diagnóstico diferencial que plantea el NPS es muy amplio ya que puede ser la manifestación de diversas patologías de etiología inflamatorio, infecciosa, anomalías del desarrollo, vasculopatías y neoplasias.
La prevalencia de nódulos pulmonares en sujetos fumadores asintomáticos es de hasta un 66%, siendo la mayoría de ellos de naturaleza benigna (99%). La TC muestra un gran número de nódulos no detectados hasta ahora, y aunque la mayoría de ellos son benignos, también tiene la capacidad de hallar cáncer de pulmón en estadios muy precoces, manifestado como NPS.
Los datos clínicos y radiográficos permiten determinar la probabilidad de que la lesión hallada sea maligna, antes de realizar otros estudios. Esto determinará la secuencia diagnóstica a seguir. De este modo, se han propuesto algoritmos en el manejo de esta lesión pulmonar, por lo que encontraremos nódulos con criterios de benignidad (no requerirán más seguimiento), nódulos con criterios de malignidad (se actuará sobre ellos) y nódulos indeterminados (plantean un problema diagnóstico y sobre ellos se aplicarán los protocolos de seguimiento y actuación).
DEFINICIÓN Y ETIOLOGÍA.
Definimos nódulo pulmonar como una opacidad esférica, bien circunscrita, de un diámetro igual o menor a 30 mm (las de mayor tamaño se denominan masa) que está completamente rodeada de parénquima pulmonar bien aireado y que no está asociado a atelectasias, afectación hiliar o derrame pleural. El término de Nódulo Pulmonar Solitario no puede ser usado en aquellos nódulos que se acompañan de otros o que coexisten con otras alteraciones pulmonares. .
Las lesiones más frecuentes son por orden de frecuencia: granuloma, carcinoma broncogénico, hamartoma y metástasis única.
Etiología benigna:
Normalmente secundarios a infecciones. Los granulomas suponen aproximadamente el 80% de los nódulos pulmonares de etiología benigna, siendo la infección por micobacterias la causa más común, seguida de infecciones fúngicas (histoplasmosis, coccidiomicosis).
Los hamartomas son una tumoración benigna compuesta por una combinación de tejidos mesenquimales (vasos sanguíneos, tejido muscular y grasa) en distinta proporción, y representan el 10% del NPS de etiología benigna.
Etiología maligna:
La etiología maligna incluye el carcinoma primario de pulmón, hasta en el 84% de los casos y la existencia de metástasis solitarias, únicas.
Cáncer de pulmón. Distinguimos:
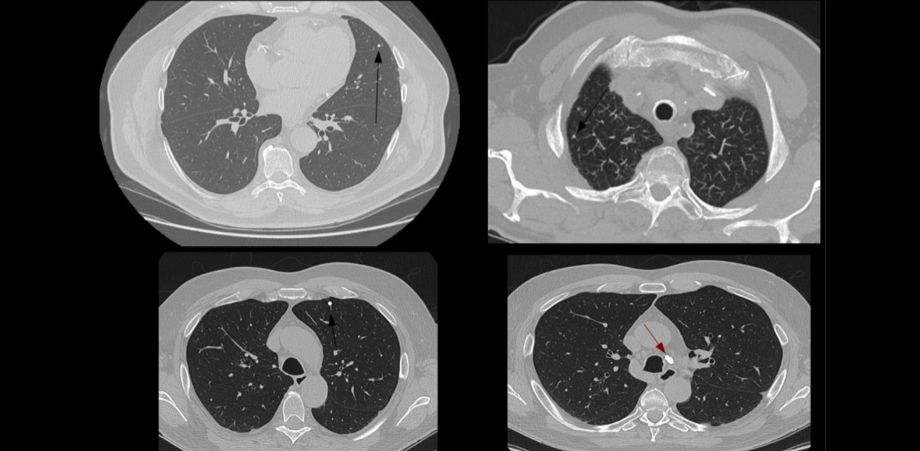
-Carcinoma broncogénico no microcítico: supone el 80-85% de los cánceres de pulmón. Incluye fundamentalmente, los siguientes tipos histológicos: epidermoide (asociado al consumo de tabaco), adenocarcinoma y de células grandes. El carcinoma epidermoide (de células escamosas) representa el 30% – 35 % de los casos y está asociado fundamentalmente al consumo de tabaco. El adenocarcinoma, representa hasta el 35% de los casos; el carcinoma bronquioloalveolar se incluye dentro de este subtipo. El carcinoma de células grandes (incluida la variedad de células gigantes), representan el 10-15% de los casos.
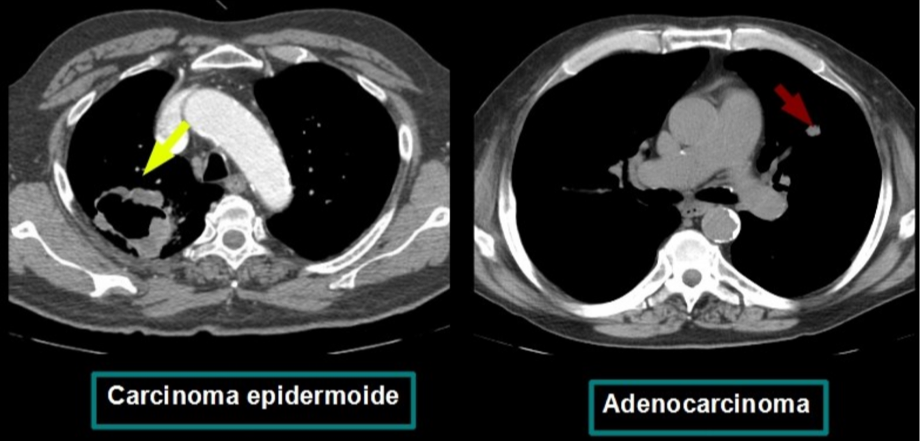
– Carcinoma de células pequeñas de pulmón: constituye aproximadamente el 15-20% de las neoplasias pulmonares.
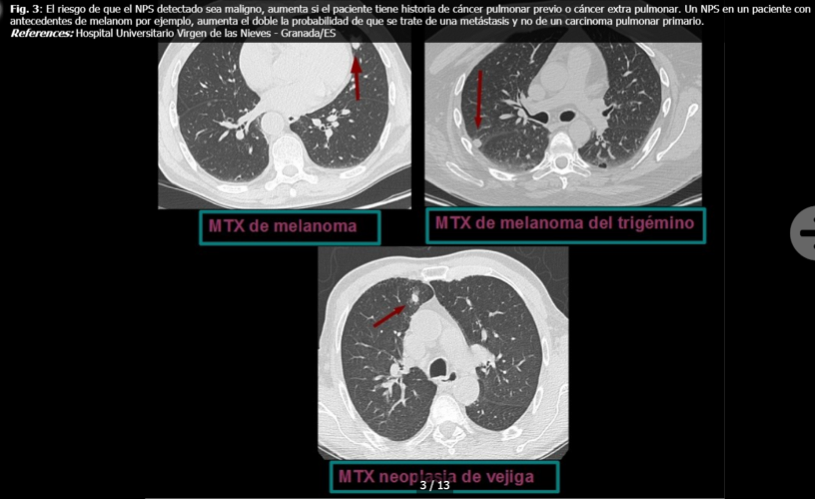
Metástasis pulmonares. La incidencia de metástasis varía con el tumor primario y el estadio de la enfermedad. Los orígenes más frecuentes son el cáncer de mama, colon, útero, cabeza y cuello.
CONSIDERACIONES CLÍNICAS
La evaluación clínica incluye la historia del paciente, la clínica y la exploración física. Los factores asociados con una mayor probabilidad de malignidad son fundamentalmente la edad (poco frecuente por debajo de los 40 años, raro en menores de 35), la historia de cáncer previo y el consumo de tabaco (principal factor de riesgo, aumenta con el grado y duración). Existen otros aspectos a tener en cuenta como son la existencia de enfermedad pulmonar obstructiva crónica (EPOC), fibrosis pulmonar de cualquier etiología o daño pulmonar por distress respiratorio o radioterapia, que aumentan la susceptibilidad de desarrollar cáncer de pulmón. La exposición a determinadas sustancias como el asbesto también supone un factor de riesgo.
TÉCNICAS DE IMAGEN PARA LA CARACTERIZACIÓN DEL NPS.
El contexto clínico y la caracterización adecuada permiten realizar un diagnóstico correcto en la mayoría de los casos. Hay diferentes alternativas en cuanto a las medidas a seguir: RX simple y TC para controles radiológicos periódicos, PET, fibrobroncoscopia con toma de biopsia, PAAF y cirugía. La biopsia y análisis anatomopatológico establece con frecuencia el diagnóstico pero debe evitarse en caso de que el nódulo sea benigno, pues es un procedimiento invasivo.
- RADIOLOGÍA SIMPLE.
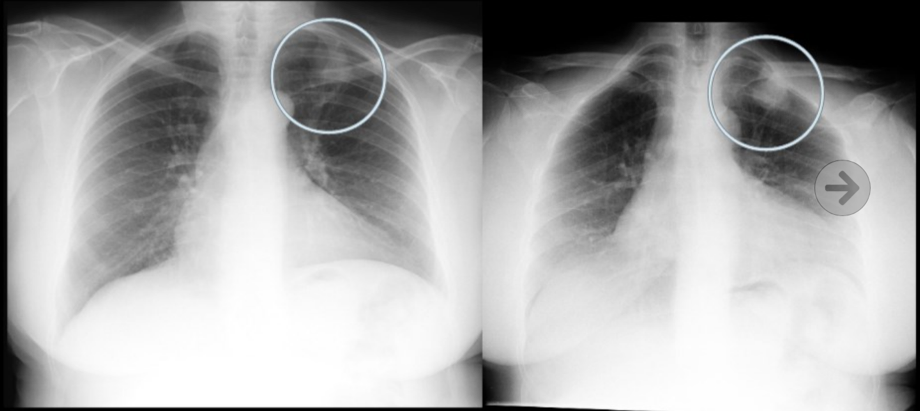
La radiografía de tórax es el estudio inicial en muchos pacientes, pero se trata de una prueba con baja sensibilidad para la detección del NPS, ya que al menos estos deben presentar unos 9 mm o presentar calcificaciones. Lo más frecuente es no detectarlos, en muchos casos debido a la superposición de estructuras, lo que también supone un aumento de falsos positivos. La existencia de estudios previos puede aportar información sobre el nódulo: si estamos ante un nódulo que no varía su tamaño en dos años y presenta un patrón de calcificación benigno, no serán necesarios más estudios.
- TOMOGRAFÍA COMPUTERIZADA (TC)
La TC constituye en la actualidad el método de elección para confirmar y valorar adecuadamente la existencia de nódulos pulmonares. Permite conocer la morfología, tamaño, contenido interno, vascularización y velocidad de crecimiento del nódulo pulmonar.
Las reconstrucciones con un grosor de corte menor, de unos 1-1.5 mm mejora la resolución espacial y la sensibilidad para la detección de nódulos. Existen muchas técnicas de postproceso ampliamente disponibles, como la proyección de máxima intensidad (MIP), volumen rendering (VR), análisis con reconstrucciones multiplanares (MPR), proyección en cine o el sistema computeraided detecccion (CAD), que mejoran sustancialmente la detección de nódulos.
- Caracterización radiológica por TAC.
- TAMAÑO
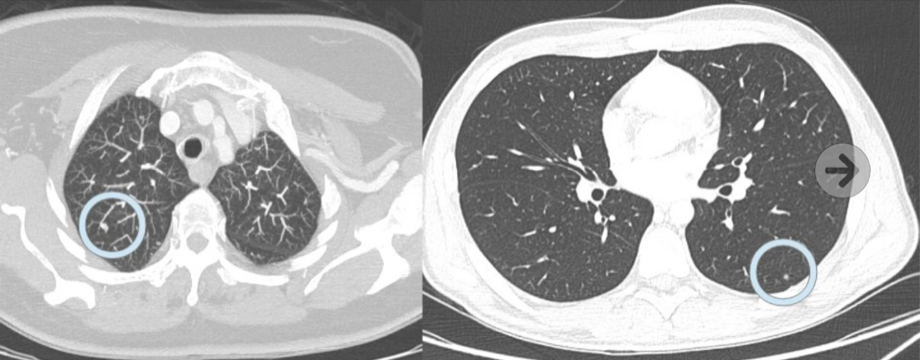
El tamaño de un NPS hallado de forma incidental, puede ayudar a diferenciar entre lesiones benignas y malignas. Por lo general, las lesiones mayores de 3cm (consideradas masas) tienen una mayor probabilidad de ser malignas. Mientras que la mayoría de los nódulos de menos de 10 mm de tamaño son benignos. El porcentaje de malignidad varía dependiendo del tamaño: 0-1% de probabilidad de malignidad si hablamos de nódulos menores de 5 mm o menos, 6%-28% entre los 5 y 10 mm y 64% a 82% en los nódulos de 20 mm o más. El porcentaje de nódulos menores de 4 mm que resultan ser malignos es muy bajo en pacientes sin antecedentes de cáncer, incluso en consumidores de tabaco, como único factor de riesgo. Sin embargo en pacientes con historia de cáncer nódulos pulmonares menores de 5 mm en llegan a ser malignos hasta en un 42 %, a pesar de su pequeño tamaño.
El tamaño en dos dimensiones debe ser obtenido midiendo el eje transverso máximo del nódulo y un plano transversal al mismo.
- VOLUMEN Y TASA DE CRECIMIENTO.
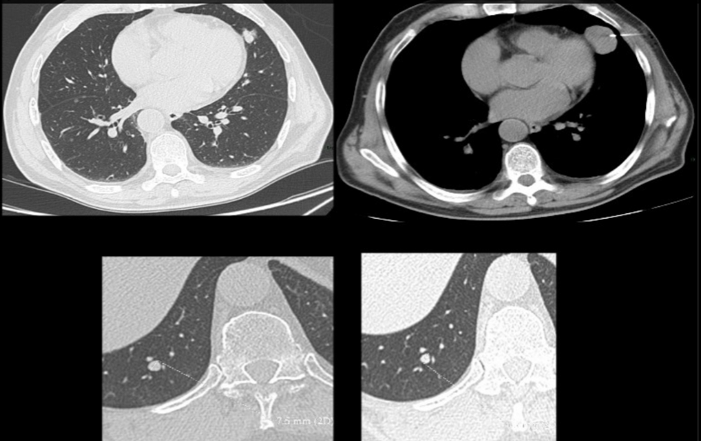
Tradicionalmente la tasa de crecimiento de los nódulos se ha valorado a partir del diámetro mayor. Sin embargo pueden existir variaciones intra e inter observador, sobre todo en nódulos de pequeño tamaño menores de 1 cm, que disminuyen la eficacia del seguimiento de estos nódulos.
Una expresión del crecimiento del nódulo es el Tiempo de Duplicación de Volumen (TDV), que hace referencia al número de días necesario para que un nódulo pulmonar duplique su volumen. El crecimiento del nódulo en un proceso tridimensional y pequeños aumentos en el diámetro, de un 26%, pueden suponer una duplicación de volumen, sobre todo en el caso de nódulos milimétricos, donde pequeños aumentos de tamaño, difíciles de observar, pueden suponer la duplicación del volumen del nódulo.
Un TDV menor de 20-30 días es sugerente de infección/inflamación aunque en algunos casos no se puede descartar la existencia de linfoma o metástasis de rápido crecimiento. TDV mayores de 400 días son asociados normalmente a lesiones benignas de lento crecimiento como granulomas y hamartomas. Los nódulos malignos tienen TDV entre 20 y 400 días. El TDV de Ca. Células pequeñas es muy corto, de unos 65 días, mientras que el del adenocarcinoma se sitúa en unos 180 días. El carcinoma epidermoide y el Ca. de células grandes presenta un TDV intermedio, de unos 90-100 días.
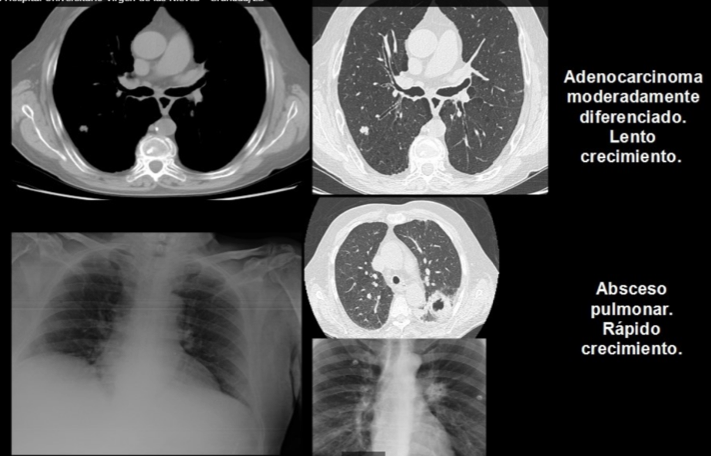
Tradicionalmente un nódulo estable durante dos años puede considerarse benigno, ya que esto supondría un TDV superior a 730 días. Sin embargo, esta premisa no puede usarse en el caso de nódulos no sólidos (ground glass) ya que adenocarcinomas de bajo grado y el ca. Bronquioloalveolar manifestados como NPS no sólidos, pueden mostrar TDV de hasta 1.346 días.
- DENSIDAD
Los nódulos pulmonares se pueden dividir en sólidos, parcialmente sólidos y no sólidos. Los nódulos sólidos son el tipo más frecuente de NPS y generalmente se producen como consecuencia de procesos inflamatorios (enfermedades inflamatorias del pulmón como TBC y micosis) que ocasionalmente pueden calcificar. Debemos tener en cuenta que la mayoría de los carcinomas primarios de pulmón y las metástasis también se manifiestan como NPS.
Los NPS no sólidos son generalmente benignos, secundarios a procesos inflamatorios, aunque pueden representar lesiones premalignas o malignas.
El patrón en vidrio deslustrado persistente se asocia fundamentalmente a Ca. Bronquioloalveolar (CBA) o adenocarcinoma de bajo grado y también puede deberse a hiperplasia adenomatosa atípica como precursora del adenocarcinoma. Los nódulos subsólidos o parcialmente sólidos presentan mayor probabilidad de ser malignos que los no sólidos. Entre el 40%-50% de estos nódulos menores de 1.5 cm son malignos y el riesgo de malignidad se incrementa con el aumento de tamaño y si el componente sólido es central. Sin embargo el “signo del halo” o patrón en vidrio deslustrado periférico no es específico y en muchos casos es signo de infección (aspergillus) o hemorragia perinodular.
Cómo ya hemos comentado anteriormente, el tiempo de duplicación de volumen es mayor en el caso de nódulos no sólidos o semisólidos, lo que deberá tenerse en cuenta a la hora de programar el seguimiento.
- CARACTERÍSTICAS INTERNAS
- Calcio
La TAC posee mayor capacidad que la RX para demostrar la presencia y el tipo de calcificación.
La presencia de calcificaciones es el dato más importante que podemos usar para distinguir una lesión benigna de una lesión maligna. La calcificación se asocia a benignidad cuando presenta uno de los siguientes patrones de calcificación: calcificación única y central (nido central denso), concéntrica, laminada y la calcificación distribuida en grumos por toda la lesión (TBC, histoplasmosis). Como excepción debemos saber que este patrón también puede verse en tumor carcinoide, metástasis de osteosarcoma y condrosarcoma, por lo que debemos tenerlo en cuenta en caso de antecedentes de este tipo de cáncer. La calcificación en palomitas de maíz es diagnóstica de hamartoma pulmonar. Cuando no existe calcificación no quiere decir que el NPS sea maligno, ya que hasta un 63% de nódulos benignos no están calcificados.
Los nódulos malignos presentan calcificaciones hasta en un 13.4% con alguno de los siguientes patrones: calcificación extrínseca (adenocarcinoma que suele asentar sobre cicatrices previas), amorfas o puntiformes, como es el caso de calcificaciones psamomatosas (tumores productores de mucina).
- Grasa
El contenido macroscópico graso es un signo sugestivo de hamartoma, añadido a la calcificación en palomitas de maíz. Salvo algunas excepciones: metástasis solitaria de liposarcoma, focos de neumonía lipoidea y metástasis de carcinoma renal.
- Cavitación
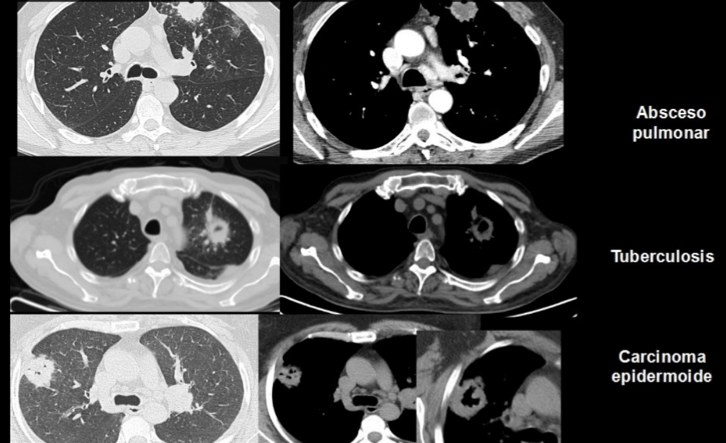
Puede observarse tanto en nódulos malignos como benignos. No es un dato que nos ayude a diferenciar por sí mismo la naturaleza del nódulo pues aparece en procesos neoplásicos, isquémicos e inflamatorios. Aproximadamente un 15 % de los cánceres pulmonares pueden formar una cavidad y suele estar en relación con la existencia de necrosis. Es más frecuente en el Ca. Epidermoide.
Sí puede resultar útil valorar el grosor y la regularidad de la pared ya que un grosor de pared fino, menor o igual a 4 mm es sugestivo de benignidad, hasta en un 94 % de los casos. Un grosor de pared igual o superior a 16 mm y un revestimiento interno irregular o nodular es sugerente de malignidad hasta en un 95% de los casos. Algunos procesos inflamatorios/infecciosos como la TBC o la aspergilosis pueden manifestar engrosamiento significativo de la pared.
- Broncograma y bronquiolograma aéreo

En la mayoría de los casos la presencia de broncograma aéreo en el interior de una consolidación puede considerarse como característica diagnóstica de un proceso inflamatorio organizado. No obstante, existen neoplasias como el linfoma o el carcinoma bronquioloalveolar que pueden manifestar broncograma aéreo, por lo que este signo no es determinante para diferenciar neoplasias de neumonías en fase de organización.
- Márgenes y forma.

Se considera que un nódulo circunscrito, bien definido y con bordes lisos es más probablemente benigno, sin embargo, determinadas neoplasias como el tumor carcinoide, el adenocarcinoma y algunas metástasis también tienden a manifestar bordes regulares. Hasta un tercio de las lesiones malignas tienen bordes lisos y casi siempre son metástasis. Una lesión espiculada e irregular con presencia en algunos casos de “corona radiada” es más probablemente maligna, ya que traduce fenómenos de reacción desmoplásica peribroncovascular, edema y engrosamiento de los septos interlobulillares aunque esto también puede observarse en algunas enfermedades granulomatosas, fibrosis y neumonías organizadas.
- Comportamiento en TC tras la administración de contraste i.v.
La vascularización y la perfusión de un nódulo maligno difieren de la de un nódulo benigno y estas pueden ser estudiadas valorando las diferencias de densidad durante las distintas fases de un estudio seriado en una misma localización antes y después de la administración de contraste i.v (TC dinámico a los 1, 2, 3 y 4 minutos tras la administración de contraste i.v.), ayudando a caracterizar los nódulos pulmonares. No es un método usado con mucha frecuencia, por el incremento y la mayor disponibilidad del uso de la PET-TC, por lo que puede ser una opción cuando la PET –TC no está disponible. Nódulos con un tamaño mayor de 7-8 mm en los que faltan características para clasificarlos como benignos, pueden ser caracterizados con esta técnica para valorar su comportamiento indeterminado. Un aumento de la atenuación de 15 HU o menos, sugieren una etiología benigna. Un realce mayor de 15HU refleja naturaleza maligna o patología inflamatoria, que incrementa el flujo de sangre, como los granulomas y la neumonía organizada. Se considera que una diferencia en la densidad superior a 20-25HU es sugestiva de malignidad junto con un lavado posterior de 5-31 HU.
PROTOCOLO DE SEGUIMIENTO.
Si se agrupa la información disponible (clínica y radiológica), existen nódulos con criterios de benignidad que no requieren seguimiento, nódulos con criterios de malignidad sobre los que se debe actuar y nódulos indeterminados, que son los que plantean un problema diagnóstico y en los cuales se deben aplicar los protocolos de seguimiento y actuación.
Los datos clínicos y radiológicos permiten determinar la probabilidad de que la lesión sea maligna, antes de realizar otros estudios (probabilidad pretest de malignidad). Como factores clínicos consideraremos: edad, historia de fumador, historia personal de cáncer en los últimos cinco años; como factoress radiológicos el tamaño, espiculación y localización en lóbulos superiores. La mayoría de los autores diferencia sin lesión mide más o menos de 8 mm y establece dentro de ellos dos grupos: alto y bajo riesgo
Antes de presentar los protocolos debemos tener en cuenta algunas consideraciones:
– Los pacientes que tengan un proceso neoplásico concomitante o sospecha del mismo deben seguir el proceso diagnóstico y protocolos propios de su situación clínica.
– Los pacientes jóvenes de menos de 35 años presentan una muy baja probabilidad de cáncer de pulmón; la incidencia es menor del 1% por lo que no se aplican los protocolos en pacientes jóvenes. Dependiendo del contexto clínico se puede optar por un control a los 6-12 meses.
– Los pacientes con fiebre inexplicada y sobre todo en determinadas situaciones clínicas como estados de inmunosupresión, pueden manifestar una infección activa con un nódulo pulmonar. Se optará por aplicación de tratamiento y re evaluación en un corto periodo de tiempo.
– Resulta fundamental el uso de imágenes previas. Si se confirma la estabilidad del nódulo durante dos años o si muestra un patrón de calcificación benigno no serán necesarios más exámenes.
– El seguimiento durante dos años no es aplicable a los nódulos no sólidos o mixtos que como hemos visto, pueden estar en relación con neoplasias de bajo grado o indolentes con crecimiento más lento y tiempos de duplicación de volumen mayores.
– Los protocolos de seguimiento no tienen en cuenta la realización de RX simple. De modo general podemos decir que en el caso de nódulos hallados por un estudio de radiología simple será necesario un estudio mediante TC, dependiendo de si:
- Existen estudios previos:
- Si se confirma estabilidad de dos años, o calcificación benigna, no será necesario.
- Lesión de nueva aparición o factores de riesgo asociados: realizar estudio por TC.
- No existen estudios previos: La realización de TC caracterizará mejor el nódulo.
Protocolo de seguimiento para nódulos de <8 mm.
En el caso de nódulos de menos de 8 mm se realiza seguimiento mediante TC o en caso de alta sospecha, caracterización histológica en función de la edad del paciente, de sus factores de riesgo y del tamaño y evolución del nódulo.
Se establecen dos grupos dependiendo de la existencia de factores de riesgo clínicos. El grupo sin factores de riesgo estará formado por aquellos con historia mínima o ausente de consumo de tabaco u otros factores de riesgo conocidos. El grupo con factores de riesgo estará formado por los pacientes con historia de consumo de tabaco e historia de cáncer en los últimos 5 años.
Debemos recordar que el tamaño es entendido como la media del diámetro mayor y el transversal al mismo, medido en el plano axial. En el caso de nódulos menores de 4 mm el seguimiento es opcional en el grupo de bajo riesgo y si hay factores de riesgo clínico o radiológico, se programa un TC a los 12 meses, ya que el riesgo de malignidad es menor del 1%, incluso si hay factores de riesgo El seguimiento con TC en 3 y 6 meses sería apropiado si existen factores de riesgo, ya que los pequeños nódulos que son estables más de 365 días es poco probable que sean metástasis pulmonares. Es cierto que un pequeño porcentaje de estos NPS malignos pasan desapercibidos de este modo pero el porcentaje es extremadamente menor que el número de estudios innecesarios que se harían.
Protocolo de seguimiento para nódulos de ≥8 mm.
En los nódulos mayores de 8 mm se pueden emplear técnicas diagnósticas más complejas como el uso de la PET-TC, estudio del realce al contraste i.v en TC, y toma de biopsia por broncoscopia, guiada por TC, videotoracoscopia o cirugía, dependiendo de la probabilidad de malignidad.
En nódulos mayores de 8 mm se podrá realizar un seguimiento por TC a los 3, 9 y 24 meses u optar por el uso de técnicas más complejas (estudio dinámico con contraste, PET y/o biopsia). Se muestra en la mayoría de los artículos que dependiendo de la probabilidad de malignidad se optará por una de las siguientes modalidades:
-Baja probabilidad de malignidad: Se optará por un seguimiento mediante TC a los 3, 9 y 24 meses.
– Alta probabilidad de malignidad: Se realizará resección del nódulo por videotoracoscopia o cirugía.
– Probabilidad de malignidad intermedia: En este caso se completará el estudio con el uso de la PET/PET-TC, el estudio dinámico con contraste i.v y la toma de biopsia (guiada por TC o por broncoscopia). Dependiendo de los resultados se optará por
– Seguimiento conservador mediante TC cuando :
- La probabilidad de malignidad es muy baja.
- La probabilidad de malignidad es intermedia y se trata de una lesión no hipermetabólica en PET-TC.
- Se trata de una lesión no hipermetabólica y la biopsia obtenida no es diagnóstica.
– Toma de biopsia si :
- Si se evidencia crecimiento del NPS a lo largo del seguimiento o adquiere características radiológicas de malignidad.
- Como confirmación diagnóstica si existe cierto riesgo quirúrgico o si la obtención de un diagnóstico histológico variará el tratamiento posterior.
- La probabilidad pre test es intermedia-alta y la PET -, es decir, existe una discordancia entre la sospecha y los hallazgos por imagen.
Dra. Sterling Arróliga Selva
Médico Radióloga-Resonancia Magnética.
Cod. 12966
BIENVENIDO A SU CENTRO DE DIAGNÓSTICO POR IMÁGENES LINDA VISTA
Cuenta con el personal científico médico y técnico en Diagnósticos por imágenes de alta calidad con experiencia en nuestro país, para la atención de los pacientes que requieren diferentes tipos de diagnóstico; además del personal de apoyo calificado, con sensibilidad humana, garantizando una excelente atención y un diagnóstico confiable.
¡Suscríbete a nuestro boletín!
Entradas recientes
- RADIOGRAFIA Y ECOGRAFIA DE HOMBRO OSTEOARTRITIS ACROMIOCLAVICULAR 7 julio, 2022
- Resonancia Magnética de Cuello 6 julio, 2022
- ¿ Qué significa lesión BIRADS 4 ? 7 noviembre, 2019
| L | M | X | J | V | S | D |
|---|---|---|---|---|---|---|
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 | 29 |
| 30 | ||||||

